摘要
生物制造作为实现绿色低碳和可持续发展的重要技术路径,正沿着“原料—技术—过程—产品”全产业链加速演进。首先,从原料端分析了传统粮食原料的局限性,重点介绍生物制造原料向非粮生物质拓展,高性能菌种及酶的开发向精准化、智能化演进,过程工程技术及核心装备向模块化、智能化迭代的最新进展,为构建安全、稳定的生物制造原料基础提供支撑。技术端系统梳理了基因编辑、代谢工程、计算设计、人工智能(AI)等底层工具在核心菌种、底盘细胞和工业酶精准设计中的应用,推动生物制造向高效化、模块化、智能化发展。在过程端,重点讨论智能细胞工厂、精准生物发酵、在线监测、数字孪生及智能装备国产化等关键技术的融合创新,加速实现由经验驱动向模型驱动与智能决策转型。在产品端,总结生物制造在医药、食品、化工、材料等领域的产业化进展及应用前景。最后,针对中国生物制造在菌种自主可控、高端装备依赖等方面的短板,提出关键技术攻关方向,为未来生物制造的技术路线与产业发展提供参考。
生物制造是指利用生物系统或其组成成分,通过原料替代、生产工艺创新或新产品开发等方式,实现能源、化工、材料、医药、食品等领域的低成本、规模化和可持续生产的一种新型工业生产模式随着合成生物学、人工智能(artificial intelligence,AI)、计算设计等底层技术的快速发展,未来的生物制造正加速从传统发酵驱动向智能化、生物设计驱动的颠覆性制造范式跃迁。这一变革不仅是制造强国建设和提升产业链竞争力的重要支撑,也是推动新型工业化、经济高质量发展以及培育未来产业的重要举措。
在全球新一轮科技革命与产业变革的浪潮下,生物制造作为生物技术与先进制造深度融合的核心方向,承载着推动制造业绿色转型的历史使命。当前,中国在众多对国民经济发展至关重要的产品制造方式上,仍大部分依赖石油化工、有机合成及植物提取等传统制备方式,存在着资源依赖强、碳排放高、技术迭代慢等结构性瓶颈。生物制造以可再生原料、绿色过程、产品可设计等优势,可辐射能源、化工、食品、医药等多个国民经济关键领域,成为破解传统制造业资源依赖高、碳排放强度大、技术迭代滞后等结构性矛盾的核心抓手。
近年来,国家层面将生物制造明确纳入未来战略体系。2024年,政府工作报告提出要“积极打造生物制造、商业航天、低空经济等新增长引擎”,并在2025年再次强调要“培育生物制造、量子科技、具身智能、6G等未来产业”,标志着中国生物制造发展进入国家战略的新阶段。在“双碳”目标驱动下,其在绿色低碳转型、资源结构优化及产业链重构中的战略价值将进一步凸显。
基于此,本文从原料、底层技术、过程智能化到产品体系的产业链视角,系统分析中国生物制造的关键技术进展、瓶颈挑战与未来发展路径,为中国生物制造的技术突破与战略布局提供参考。
1 生物制造的关键技术发展趋势
生物制造是利用生物技术和生物过程,通过微生物、酶、植物或动物细胞等生物体作为生产平台,制造各种化学品、材料和能源等产品的可持续生产模式。生物制造的核心产业链包括原料供应、生产平台(菌株与酶)、装备、过程与工艺、产品管理与废弃物处置等环节(图1)。方法层面包括实验、计算模型与智能技术等,形成了一个多维度、综合性的技术体系。应用领域覆盖了能源、化学品、材料、食品、农业、医药、化妆品等多个行业,并在不断拓展和深化中。
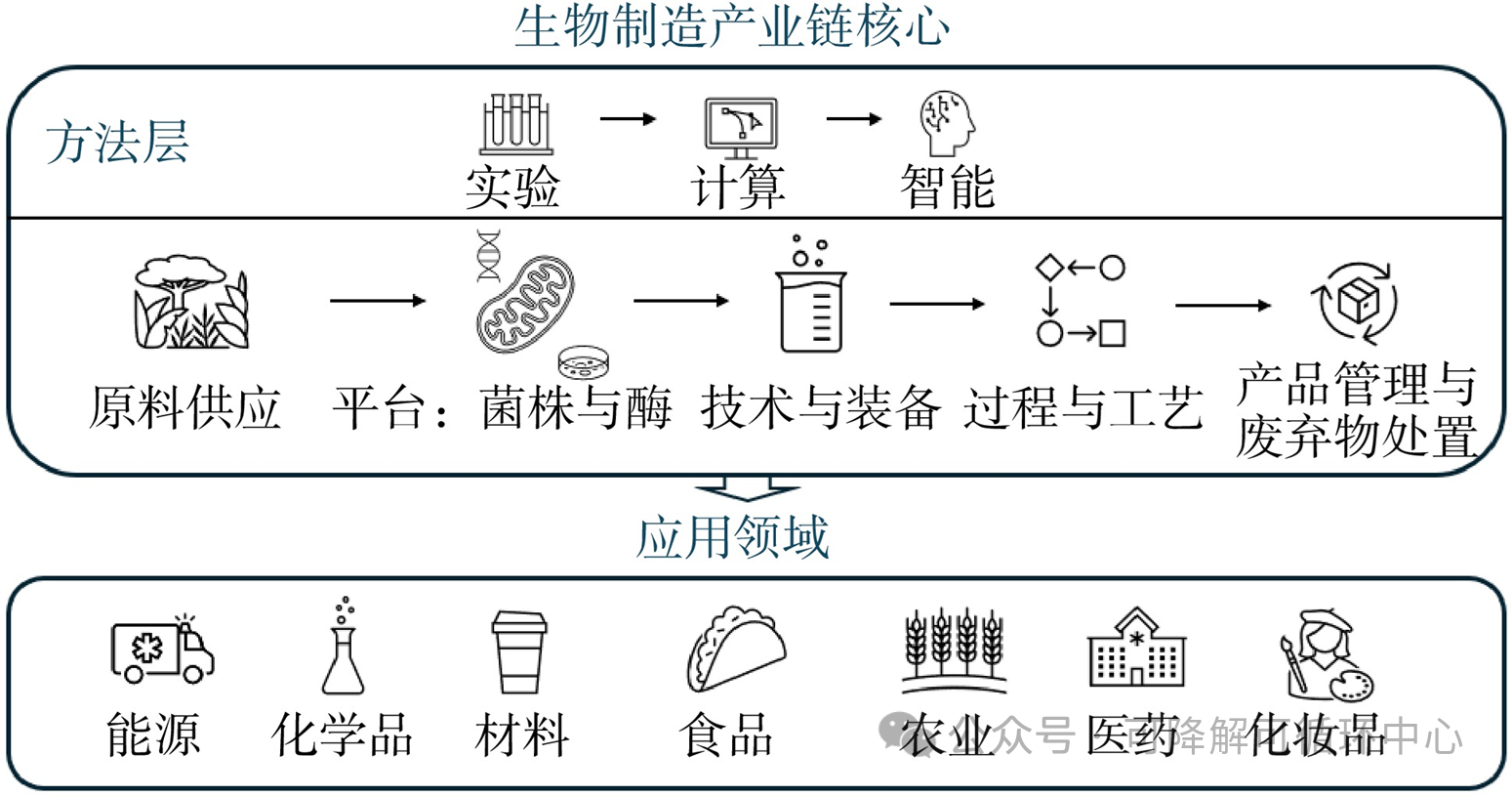
生物制造作为一种新兴的工业生产模式,经历了从基础研究到技术应用的多次革新。早期的生物制造主要依赖传统的微生物发酵技术,用于生产基础化学品和生物制品,如抗生素、酶制剂和氨基酸等。随着生物技术的不断突破,特别是基因工程和合成生物学的发展,生物制造逐渐进入了高精度、高效率的时代。近年来,生物制造底层技术与关键核心技术研发不断取得突破,新产品开发速度和过程工艺的绿色环保水平大幅度提升,新兴产业快速兴起,辐射应用领域也在不断深化和扩大,以下简要介绍生物制造产业链一些关键技术的融合发展情况。
1.1 生物制造原料向非粮生物质拓展
传统的生物制造主要依赖可发酵糖质原料 (如来自玉米、甘蔗等粮食作物的葡萄糖和蔗糖),为微生物代谢提供必须的碳源与能量。随着木质纤维素和一碳化合物高效利用技术的不断突破,生物制造的原料体系正逐步从 “粮食依赖” 向更多元化的非粮生物质拓展。这些新型原料不仅有效缓解了生物制造对可食糖类原料的高度依赖,也有助于减少与粮食生产在土地和资源上的竞争。
尤其值得关注的是一碳化合物,如二氧化碳 (CO₂)、一氧化碳 (CO)、甲酸 (CH₂O₂)、甲醇 (CH₄O) 等,正成为下一代生物制造的重要候选原料。通过微生物或生物催化体系将一碳分子转化为多碳化学品,不仅能够优化原料结构,还能显著提升资源利用多样性与制造过程的可持续性。与此同时,石油化工和煤化工过程中的副产品,如甲酸、甲醇、乙酸、丙酸、丁酸等各种有机酸,也被视为下一代生物制造的重要原料。这些副产品可用于合成生物材料和多种小分子化合物,进一步拓展了可利用碳源的范围。
在具体技术实践上,美国 Ginkgo Bioworks 公司开发的工程菌株已能够高效将木质纤维素水解产物转化为稀有糖,产率提升 40% 以上。诺维信公司设计并开发的新型纤维素酶和酵母菌株,则能够将纤维素向乙醇的转化率达到 92%,每生产 1 t 纤维素乙醇,便可减少 3.5 t 二氧化碳排放,为低碳生物制造提供了有力支持。更前沿的平台如 LanzaTech 公司的气体发酵技术,则能直接将一碳气体转化为乙醇等可持续化学品,开创了 “负碳生产” 的新模式,为低碳绿色制造提供了新的解决方案。
1.2 高性能菌种及酶的开发向精准化、智能化演进
在生物制造体系中,微生物菌种是负责原料转化和产品合成的“生物工厂”,而酶则作为其中的“生物催化剂”,加速和调控代谢反应。通过菌种自身的代谢途径和酶的催化作用,微生物能够高效地将多种碳源转化为药物、化学品、生物材料等目标产物。因此,高性能菌种与高效酶体系的开发是提升生物制造生产效率、降低生产成本和优化产品质量的核心因素。
传统生物技术主要依赖实验研究、数据分析和模型辅助,通过物理、化学和生物学方法对生物过程进行改造。尽管在基因工程、发酵工艺 、细胞培养及医药研发等领域取得了显著进展,但在处理海量复杂数据、预测未知结果和优化实验流程方面仍存在显著局限,难以满足现代生物制造对效率和精度的高要求。
随着基因编辑技术的持续突破,特别是成簇规律间隔短回文重复序列 (CRISPR) 技术的广泛应用,微生物代谢途径的精准调控与系统重构进入了快速发展阶段。CRISPR 系列工具实现了对基因组的精准、可编程化改造,为酶分子工程、底盘细胞重构以及复杂调控网络设计提供了强大支撑。由此,生物制造从传统的经验式改造,迈向机制驱动的精准代谢工程新时代,使细胞 “按需设计” 的愿景逐步成为现实。
与此同时,非模式微生物和极端微生物底盘的开发取得重要进展。嗜盐菌、嗜热菌和嗜酸碱菌等极端环境微生物展现出作为 “下一代细胞工厂” 的巨大潜力,不仅具有更高的耐受性和更广泛的底物适应性,也能支撑更为复杂且高效的生物合成路径。围绕标准化细胞工厂建设,美国与欧盟等相继布局 “生命铸造厂” 和 “微生物细胞工厂” 等重大战略计划,推动底盘细胞资源化、模块化与工程化发展。此外,国际大型生物科技公司也在不断加强工业菌种研发平台的建设,通过打造核心菌种来提升市场竞争力。
在精准化技术快速演进的同时,AI 正成为推动菌种与酶设计智能化的关键驱动力。基于 “AI for Science” 新范式,AlphaFold、RFdiffusion等 AI 工具使蛋白结构预测、酶活位点优化、突变体设计等流程获得指数级提升,大幅提高了酶分子工程与微生物代谢优化的效率。结合多组学数据整合与可解释性代谢网络建模,AI 已能辅助建立更准确的细胞代谢图谱,实现代谢瓶颈识别、通路优化和策略自动生成。由此,菌种开发正从传统的 “试错优化模式” 转向机制驱动、数据驱动、智能决策、定制合成的新时代,为精准化与智能化的生物制造奠定了坚实的技术基础。
产业界和学术界正在构建基于 AI 的全流程自动化平台,典型案例包括:美国伊利诺伊大学开发的集 AI 设计 - 构建 - 测试 - 学习于一体的智能工程化平台,已应用于番茄红素生物制造;Ginkgo Bioworks 公司通过引入 AI 和自动化机器人技术,实现了基因设计、合成、导入、目标细胞筛选以及培养条件优化等环节的全面自动化和高通量化,推动了基因工程的产业化。类似的液体处理机器人、自动化克隆筛选系统和标准化培养与检测系统的科研平台不断涌现,也显著提高了微生物及功能元件的研发效率。
在战略层面,美国政府已将AI与生物技术融合列为国家战略重点。2022年,美国总统签署“国家生物技术和生物制造计划”,未来5年将对100万种微生物的基因组进行测序,并系统解析至少80%的新发现基因功能,预计在未来20年大幅加速新基因、新陈代谢及功能的发现与应用。这一战略不仅推动生物制造智能化升级,也为生物技术创新提供了政策和技术范例。通过这种跨环节智能化赋能,AI正在推动生物制造从实验室探索走向规模化、智能化和精准化,为产业升级和可持续发展提供新动力。
1.3 过程工程技术及核心装备向模块化、智能化迭代
传统生物制造在工业化过程中面临诸多瓶颈,如装备柔性不足、工艺放大受限、跨尺度生产数据割裂等问题,这些都严重制约了产品转化效率。为应对这些问题,生物制造过程工程正在朝着模块化和智能化系统集成的方向发展,通过底层工艺重构与顶层系统集成的双向创新,推动装备设计理念和生产范式的升级,实现从实验室到工业生产的无缝衔接。
模块化设计通过标准化生物反应器、分离纯化单元等功能模块的解耦,实现了“即插即用”式柔性组装,大幅提高了工艺的灵活性和拓展性。例如,赛多利斯(Sartorius)公司推出的Ambr®模块化微型生物反应器阵列,可支持并行化条件筛选与工艺优化,显著加快生产参数的调控。与此同时,集成的AI算法能够实时监控和调整溶氧、pH值等关键参数,提升细胞培养效率,增强生产过程的稳定性和可控性。
进一步地,虚拟反应器模型的构建使工艺预调试、故障预测与动态优化成为可能,从而提高了生产过程的精确性与可靠性。在制造工艺中,增材制造等个性化、精准化技术的引入使得复杂组织和器官的仿生制造成为现实。未来,随着技术的进步,将突破现有的单分子检测极限,并通过跨学科协同推动技术向更超高通量和更高精度的方向发展。
此外,响应环境刺激的材料开发、分离效率和选择性的提升,将成为未来研究的重点方向。依托工业物联网构建的大数据平台,将为机理−数据混合模型的优化提供重要支持,推动分离工艺的持续创新和效率提升。
2 中国生物制造的核心技术问题与挑战
经过国家前期的总体布局,中国生物制造整体实力已接近国际先进水平,部分领域已实现领先。然而,与美国和欧洲等发达国家和地区相比,中国在生物制造领域仍面临一系列技术与产业挑战,以下从产业链不同阶段简要阐述几个关键的技术问题(图2)。
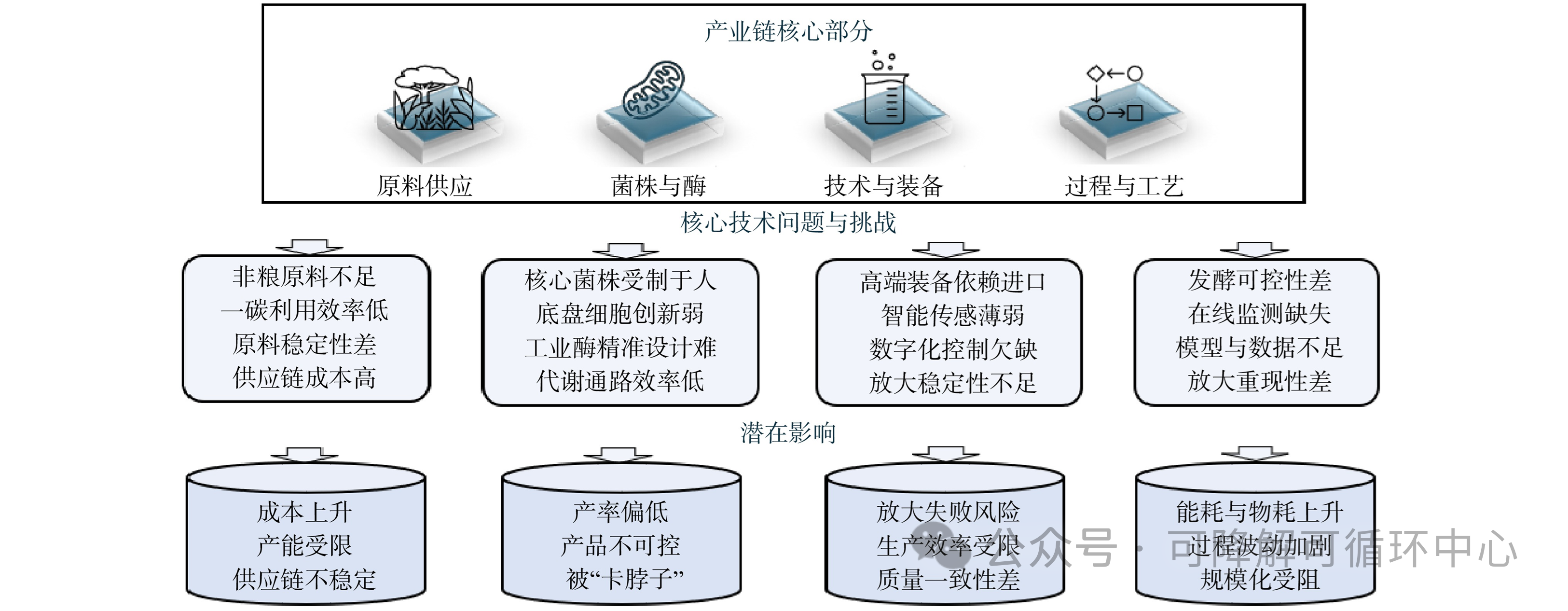
图2 生物制造产业链关键技术问题与挑战
2.1 资源利用与原料替代的技术瓶颈
目前,中国生物制造产业主要依赖以淀粉类物质为代表的粮食资源,约90%的初级原料来自玉米等粮食作物。例如,每生产1 t柠檬酸,大约消耗1.9 t粮食原料。在生物基塑料、生物基化学纤维等关键领域,粮食作物的依赖性同样较强。这种“以粮造料”的模式不仅加剧了“与民争粮、与畜争饲”的资源矛盾,还削弱了产业原料供应的安全性和自主可控能力,成为制约生物制造可持续发展的重要障碍。
相比之下,中国非粮生物质资源极为丰富,年产量超过35亿t,涵盖农作物秸秆、林业废弃物及有机生活垃圾等多种类型,具有巨大的资源潜力。然而,在非粮生物质的利用上仍面临较大挑战,包括收储物流成本高、糖化效率低、酶制剂成本高,以及材料批次稳定性差等技术与经济瓶颈,尚未实现规模化和高附加值的有效利用。因此,构建多元化、非粮化原料体系,已成为推动生物制造高质量发展、突破资源约束的关键突破口。
2.2 核心菌种的自主可控性问题
中国在微生物菌种资源的自主掌控能力上仍存在明显短板,关键工业菌种和酶制剂的高度依赖已成为制约生物制造产业高质量发展的重要瓶颈。目前,超过80%的工业菌种依赖进口,尤其在多个具有国际竞争力的领域中,中国的进口依赖程度较高。例如,2024年中国饲用氨基酸供应量约489万t,同比增长12.9%,占全球比例达70%,但底盘自主菌种的比例不足20%。此外,发酵工业所需的酶制剂中,超过80%依赖进口,尤其是在食品酶和工业洗涤酶等高端酶制剂领域,国外品牌近乎形成垄断。
随着中美贸易摩擦的加剧,特别是2025年4月4日起美国对中国科研人员访问敏感生物医学数据的限制,中国在生物资源领域的被动局面愈加明显,进一步凸显了核心资源自主可控的紧迫性。因此,提高微生物资源的自主掌控能力,已成为保障国家生物安全、推动生物制造产业高质量发展的首要任务。
2.3 生物催化剂设计与底层技术短板
中国在生物催化剂智能设计领域起步较晚,与国际先进水平仍存在显著差距。目前,国际领先机构已在酶功能预测算法精度、结构−功能关联建模、数据资源积累以及去注释化预测等关键技术方面建立了系统性的技术壁垒。而中国在酶设计、分子对接等核心技术环节,仍大量依赖国外开发的如AlphaFold、RoseTTAFold、AutoDock等算法与平台,关键技术的自主性亟待突破。
在菌种构建方面,中国普遍通过敲除或过表达合成途径中个别基因来优化菌种,但这种方法周期长、效率低,难以满足高性能工业菌种快速构建的需求。与此相比,国际领先企业已将基因编辑技术与AI算法深度融合,实现了菌种构建过程的高精准性、高稳定性和商业化成熟度。相比之下,中国在菌种设计的基础算法与软件开发、高性能底盘细胞优化、基因元件性能评估及表达调控的精细化等方面仍处于追赶阶段,亟需加快自主构建工程化菌种系统平台,推动技术集成和自主创新。
2.4 高端装备与智能制造能力的不足
中国生物制造在装备与自动化体系方面存在明显短板,尤其是在高端科研仪器和关键生产设备的对外依赖度较高,这已成为制约自主创新与产业安全的关键因素。在生产应用端,装备的智能制造、标准化加工、在线检测与智能控制等环节尚未形成完善的体系,核心设备如高端生物反应器、高效分离介质与高精度仪器等仍严重依赖进口。欧美国家通过技术出口管制、专利壁垒等手段加以限制,若无法实现国产替代和底层技术突破,产业升级将面临长期“卡脖子”风险。
在自动化成套系统的研发方面,中国也处于滞后状态,尤其在高端控制系统 (如工业软件和可编程逻辑控制器) 方面,市场份额的 95% 被国外厂商垄断。同时,智能制造所需的精密传感技术、智能控制算法等基础技术也大多依赖进口,进一步削弱了生产过程的自主可控性。这些技术瓶颈严重制约了装备系统的自主性和生产过程的智能化升级。因此,构建具有自主知识产权的高端装备体系,发展智能化、标准化和可控的制造平台,是推动中国生物制造跨越式发展的关键支撑。
3 中国生物制造未来关键技术发展方向与关键任务
为实现生物制造的规模化、智能化和绿色化发展,亟需围绕全产业链核心环节开展系统性的技术攻关。未来生物制造的技术突破将集中在原料供应、细胞工程、装备体系与过程控制以及终端产品拓展4大方向。围绕这些关键环节,必须构建以非粮资源和一碳原料为基础的绿色原料体系,推进酶与菌种的智能设计与精确调控,打造高效智能的装备与工艺平台,并加速多领域产品体系的拓展。以下将从原料端、细胞工程、装备过程和产品应用等方面系统阐述未来生物制造的关键技术发展方向与核心任务(图3)。

3.1 原料端:发展一碳原料转化与非粮资源的利用技术
针对二氧化碳、一氧化碳、甲烷等低成本可再生碳资源,以及农作物秸秆、林业废弃物和木质纤维素等丰富的非粮生物质资源,未来应重点发展高效的原料转化关键技术。具体任务如下。
1) 一碳原料高效转化。开发可再生能源驱动的二氧化碳转化技术,实现二氧化碳到甲醇、甲酸、乙酸等低碳可发酵原料的高效制备。其次,构建一碳原料合成氨基酸、有机酸、化工醇、有机胺及烃类化学品等目标产品的生物合成途径。开发可高效利用一碳原料的新型发酵技术和化学/多酶级联催化体系,突破一碳原料到目标产品生物合成技术。
2) 非粮生物质资源利用。充分利用中国丰富的非粮生物质资源,包括农作物秸秆、林业废弃物和木质纤维素等,开发高效糖化、酶解及发酵技术,实现原料的高转化率与高附加值利用。构建木制纤维素原料的智能化生物利用路线,包括定制化酶制剂体系和高性能底盘菌株开发,实现从原料到目标化学品的高效转化。
3) 智能化与工程化应用。打通一碳原料及非粮资源的高效人工生物利用路径,构建智能生物发酵和催化技术平台。完成一碳原料与非粮资源向化学品生产的工业放大验证与全生命周期评估,推进规模化生产示范与推广应用。
通过以上技术突破,可构建以一碳化合物与非粮生物质为基础的生物制造原料体系,为低碳、高效、可持续的化学品工业制造奠定基础。
3.2 细胞工程的智能设计与创制
在生物制造体系中,酶和菌种是生物制造的核心驱动要素,因此,未来生物制造的重点之一是发展工业酶和菌种的精准挖掘和智能设计技术。具体发展方向如下。
1) 工业酶的智能开发。
深入解析重要酶种的催化机制与构效调控原理,结合AI模型和大数据分析,精准发掘具有全新功能、新颖序列和高生物活性的酶基因资源。与此同时,开发新型生物基元反应,利用酶催化反应替代传统化学难以合成的反应,将为生物制造提供更加绿色和高效的解决方案。此外,还需开发适配性强的固定化材料与技术,实现高性能固定化酶制剂的低成本规模化制备,从而拓展其在能源、化工、医药、轻工和食品等多个领域的应用。最终,要构建基于AI驱动的工业酶智能开发技术体系,开发涵盖酶设计、筛选、优化等功能的大型软件平台,建立自主可控的核心数据库与算法,实现酶信息的精准挖掘和性能提升方法的快速创新。通过这一转型,工业酶的开发将从传统的“经验驱动”向“计算驱动”范式过渡,推动生物制造的智能化与绿色低碳转型。
2) 智能细胞工厂与精准生物发酵。
未来,生物制造的关键技术突破将集中在智能细胞工厂、精准生物发酵和智能装备的开发上。因此,应开发基于规则、数据驱动和AI方法的基础开源工具和算法,致力于细胞的AI建模,为细胞工厂的设计和优化提供指导。这将显著提高其在工业生产中的性能和产量。其次,建设极端微生物资源库,并开发高效基因编辑技术,以大幅提升非模式微生物细胞工厂的制造能力。同时,利用AI分析大规模生物数据,通过数字孪生及其与知识图谱结合等数字化手段,建立集细胞代谢与过程控制为一体的智能细胞工厂技术。完成自主创新的细胞工厂数字建模的算法、工具及软件开发,发展形成完整的高精度数字细胞模型底层共性技术体系,包括数据采集、处理、模型构建、算法优化等方面的技术规范和标准,显著提高细胞工厂设计和优化的效率和精准度。
通过上述技术突破,生物制造将从传统经验驱动的模式转向智能化、绿色低碳的工业化生产,实现酶与菌种的快速开发、智能化发酵和高效工艺优化。
3.3 装备与过程:智能细胞工厂、精准生物发酵、智能装备
在生物制造过程中,装备与过程的智能化升级是推动高效、绿色、精准生产的关键。未来发展应重点围绕以下几个方向。发展多元化的生物过程智能感知设备与在线检测技术,实现溶氧、pH值、温度、底物浓度及代谢产物等关键参数的实时高精度监测。融合大数据和AI等前沿技术,建立精准放大模型。通过开发智能生物反应器和过程强化技术,构建“智能感知—智能决策—智能调控”的生物反应过程智能控制系统。此外,建立关键支撑材料数字设计平台,研发高精准度分离介质(如微球、晶态材料、膜介质等),并开发连续化分离工艺及装备,推动新一代智能生物制造系统的构建。
1) 高性能分离与材料技术。
建立关键支撑材料的数字化设计平台,开发高精度分离介质,包括微球、晶态材料、膜介质等,实现分离效率和选择性的双重提升。推动连续化分离工艺及装备的研发,实现过程集成化、模块化与可扩展性,为大规模生产提供支撑。探索响应性材料和智能分离技术,使分离过程能够根据环境变化或产品特性实现动态调控,提高工艺的灵活性和稳定性。
2) 智能装备与过程集成。
构建智能化、模块化的生物制造系统,将发酵、分离、检测、控制等环节实现系统集成,实现实验室—中试—工业生产的无缝衔接。结合AI与工业物联网技术,实现生产过程的实时数据分析、故障预测与优化调控,提高生产效率、降低能耗和资源消耗。推动智能装备与细胞工厂、精准生物发酵的深度耦合,为生物制造的绿色低碳、柔性化和高通量化提供支撑。
通过上述技术体系建设,未来生物制造装备与过程将实现高度智能化、精细化与模块化,显著提升生产效率、产品质量和可持续性,为下一代生物制造产业的规模化与工业化奠定基础。
3.4 产品端:生物制造驱动的多领域产品体系拓展
随着生物制造技术的快速进步,其应用正由传统医药领域加速向能源、化工、材料、食品、农业和环境治理等多领域渗透,形成覆盖全产业链的新型产品体系。生物制造不仅催生了高能量密度生物燃料、可持续材料、环境友好型产品和创新食品等新兴产品,更推动了产业结构重构与新业态涌现,带来显著的经济效益、社会价值和战略意义。
1) 能源领域推动绿色低碳替代。应重点布局生物航空燃料、生物氢能等可再生替代能源。这类产品是航空、交通等行业实现深度脱碳的重要路径,也将成为未来能源体系的重要组成部分。
2) 化学品领域突破生物基平台化合物。应重点突破生物基有机酸、多元醇、胺类等平台化合物的合成瓶颈,结合人工代谢途径与模块化多酶催化体系,提升其向聚酯、聚酰胺、聚氨酯等高分子材料转化效率,为化工行业脱石化、降碳化提供重要支撑。
3) 材料领域构建可再生材料体系。材料端应大力发展高性能可降解塑料、生物基纤维、复合材料等关键产品,解决力学性能与环境降解性之间的平衡问题,实现功能化改性与产业化放大,推动材料体系从石化依赖向可再生资源依托转型。
4) 医药领域合成生物学驱动药物创新。应加快合成生物学驱动的药物中间体、中药活性成分、天然产物和疫苗的开发,实现从菌种设计、路径构建到生产放大的体系化创新,通过高通量筛选和计算辅助设计提升效率与纯度,以增强中国医药产业的国际竞争力。
5) 食品与农业构建非耕地依赖型营养供应体系。在食品和农业领域,应大力发展替代蛋白、代糖、功能性食品和生物农资产品,推动农业绿色转型与粮食安全保障。以蛋白为例,中国饲用蛋白年缺口近4000万t,年进口大豆超1亿t。因种源限制,中国大豆单产是美国的58%,种植成本是美国的1.35倍,如需满足需要,中国大豆种植面积需增加7.2亿亩或增产4.79倍,短期内难以实现。生物制造可通过一碳气体发酵以及与大宗化学品发酵联产等方式获得优质菌体蛋白,可构建“非耕地依赖型”蛋白供应链,为保障中国粮食安全做出重要贡献。
6) 环境治理与高端精细化应用,拓展战略新兴赛道。在环境治理方面,应发展生物降解材料与绿色修复制剂,为实现“碳达峰、碳中和”目标提供有力支撑;在高端精细应用方面,应面向消费升级与产业前沿,推动天然色素、香精香料、化妆品活性成分以及国防航天特殊材料的发展,提升中国在新兴产业和战略产业中的国际话语权。
总体来看,产品端的发展不仅关乎生物制造产业的经济效益和市场规模,更关系到国家能源安全、产业升级、生态环境保护和人民生活质量。通过在能源、化学品、材料、医药等基础领域形成稳固支撑,并在食品农业、环境治理和高端应用等新兴方向实现战略拓展,中国有望建立起覆盖全产业链的生物基产品体系。未来,需要通过政策引导、标准建设、示范推广和国际合作,加快推动生物制造产品的规模化应用与国际化发展,使其成为支撑绿色低碳转型和可持续发展的重要产业支柱。
4 结论
本文围绕生物制造技术的最新进展与未来发展趋势进行了深入探讨。随着科技的不断发展,生物制造已逐渐从传统的以粮食为原料、依赖手工实验的模式,转向更加智能化、绿色低碳、非粮资源化的生产路径。通过集成AI、基因编辑、酶催化等先进技术,生物制造技术不仅提升了生产效率,减少了资源消耗,还大大降低了对环境的负面影响,推动了产业的可持续发展。
未来,生物制造将着重突破智能细胞工厂、精准生物发酵与核心装备国产化等关键技术,构建更高效、稳定、安全的制造体系。智能化技术的深度融入将推动生物制造由经验驱动向“计算驱动−−智能决策”转型,加速细胞工厂设计、路径重构与过程优化。同时,非粮资源和一碳原料的广泛应用,将为生物制造开辟全新的原料供应渠道,减缓传统粮食资源与生物制造之间的竞争与矛盾,提升产业韧性。
尽管中国在生物制造领域已取得显著进展,但仍面临许多挑战,如核心菌种的自主可控性问题、智能设备与高端装备的研发滞后,以及关键技术的自主创新能力不足等。为应对这些挑战,必须加大基础研究投入,推动关键技术突破,进一步提升产业自主可控能力。
总体来看,生物制造技术已在全球范围内呈现出智能化、绿色化和规模化协同推进的发展趋势。通过持续的技术创新、产业体系提升与政策制度保障,中国有望进一步夯实在生物制造领域的核心竞争力,为推动全球绿色经济和可持续发展发挥更加重要的引领作用。







